Cookie Settings
当社は、お客様に最適な体験を提供するためにクッキーを使用しています。 技術的に必要なクッキーはショッピングを可能にするために使用され、統計は匿名化されたGoogleアナリティクスに使用されます。 すべては、更新された プライバシーポリシー.
| サンプル素材 | 人間のバフィーコート10ml |
| 分離方法 | 280µl CD14 S-pluriBead®抗ヒトまたは300µl M-pluriBead®抗ヒトを使用した非磁性体 |
| 収量 | ~6 * 10^6 S-pluriBead® または ~12 * 10^6 M-pluriBead®。 |
| バイタリティ | >92% (トリパンブルー染色) |
| 純度 | ~97% |
可溶性 CD14 を減らすために、付属の洗浄バッファー(PBS + 0,05 % BSA と 2 mM EDTA、pH 7,4)でサンプルを 2 回洗浄します。サンプルチューブに単球分離用のpluriBead CD14を添加し、pluriPlixまたはワイピングローリングミキサー上で20分間インキュベートする。
単離後、1mlのRPMI 1640-medium(+10 % FCS、1x Pen/Strep)に再懸濁し、細胞数を測定する。24ウェル細胞培養プレートでの単球の培養には、ウェルあたり100万個の細胞を使用し、1mlの単球培養培地(RPMI 1640 + 10 % FCS、1x Pen/Strep、2000 U/ml GM-CSF und 200 U/ml IL-4)を37℃、5 %の二酸化炭素でインキュベートする。
24h後、培地を除去し、新鮮な単球培養培地1mlを加える。その後、細胞をさらに4日間培養する。合計5日後、100ng/mlのLPSで細胞をさらに24h刺激する。活性化した細胞をトリプシンで除去し、CD1a、CD14、CD83の蛍光分析により、単球から無端細胞への成熟率を検出する。
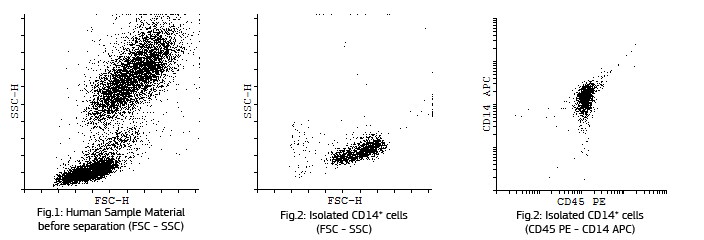
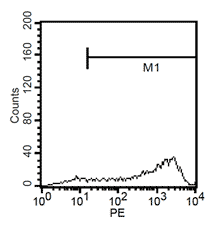
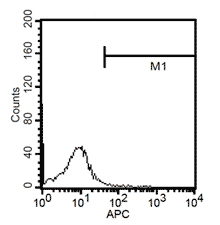
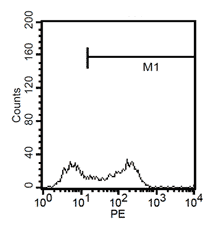
成熟した求心性細胞CD11a+, CD14+, CD83+の蛍光分析
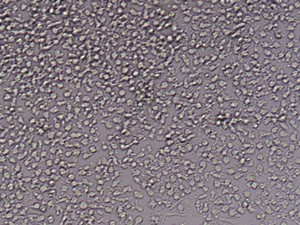
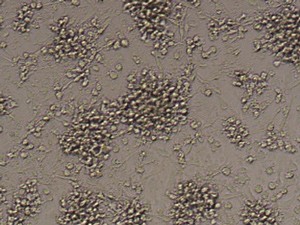
培養単離後のCD14+細胞、GM-CSIF/IL-4を用いた5日間培養後の単球の樹状細胞への成熟、LPSによる刺激後の樹状細胞への成熟